Kathodischer Korrosionsschutz
Korrosion wird im Normblatt DIN 50 900 folgendermassen definiert:
„Unter Korrosion versteht man die Zerstörung von Werkstoffen durch chemische oder elektrochemische Reaktion mit ihrer Umgebung.“
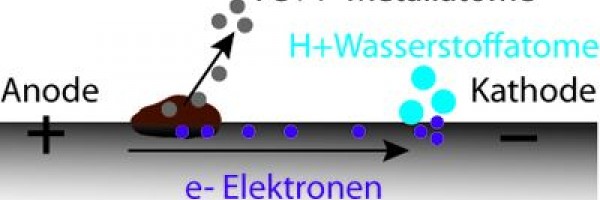
Die Zerstörung von Metallen durch die Anwesenheit von Wasser ist ein elektrochemischer Vorgang. Hierbei wirkt das Wasser als Elektrolyt und es entsteht eine galvanische Elementbildung. Bei diesem Korrosionsvorgang tritt ein Metallatom unter Zurücklassung einer oder mehrerer Elektronen aus dem festen Metallgitter als positives Ion in die Flüssigkeit. Die zurückgelassenen Elektronen wandern auf der metallischen Oberfläche zur Kathode und werden dort durch verschiedene Kathodenreaktionen verbraucht. Die Stellen, an welchem der Korrosionsablauf stattfindet, werden Elektroden genannt. Die Elektrode, an welcher die Metallatome das Gefüge verlassen, wird Anode genannt. Die Elektrode, an welcher die Elektronen verbraucht werden wird Kathode genannt.
Entstehung eines Lokalelementes
Metallische Oberflächen sind nicht homogen. Selbst reines Metall bildet unterschiedliche Bereiche mit verschiedenen Reaktionsfähigkeiten. Andere heterogene Distrikte entstehen durch Deckschichtbildung und unterschiedliche Gefüge in der Legierung. Häufig stehen auch unterschiedliche Metalle in leitender Verbindung (Eisen und Messing, Chromstahl und Kupfer etc.). Das Wasser schliesst als Elektrolyt den Stromkreis, womit überhaupt erst eine Korrosion stattfinden kann, und es entstehen durch den Angriff des Wassers verschiedene Lokalelemente.
Korrosion ist eigentlich ein natürlicher Vorgang, da das Metall in freier Natur nicht rein vorkommt. Die verschiedenen Metalloxyde werden durch hohe Energieaufwendungen zum Metall reduziert. Das dabei entstehende Metall ist instabil und geht bei der Korrosion wieder in den energetisch vorteilhaftesten Zustand über.
Kathodischer Innenschutz
Der Kathodische Korrosionsschutz macht sich die oben erwähnten Abläufe zu nutzten. Der Korrosionsstrom fliesst von der Anode an die Kathode. Die Kathode wird dabei nicht abgebaut, an ihr treten nur die Elektronen aus, die mit den H+ Ionen des Wassers reagieren. Die Anode hingegen geht in Lösung.
Beim kathodischen Schutz wird auch die anodische Oberfläche des zu schützenden Objektes zur Abgabe von Elektronen gezwungen. Diese anodischen Bereiche werden somit auch zur Kathode. Dies ist möglich, weil man in das zu schützende Objekt eine Überzahl an Elektronen „drückt“, damit auf der gesamten Oberfläche eine Elektronen-Abgabe stattfindet.
Man unterscheidet zwei Schutzverfahren:
- Einsatz von galvanischen Anoden. Diese besitzen eine grosse Differenz in der elektrochemischen Spannungsreihe bezogen auf das Schutzobjekt. Galvanische Anoden sind löslich und werden aufgebraucht. Man muss sie periodisch kontrollieren und gegebenenfalls reinigen oder wechseln.
- Einsatz von Fremdstromanoden. Es gibt lösliche und unlösliche Fremdstromanoden. Wir verwenden nur unlösliche Titan-Mischoxyd-Anoden. Diese Anoden werden isoliert in den Behälter eingebaut und über einen Potentiostat mit Fremdstrom gespiesen.
Unlösliche Fremdstromanoden sind grundsätzlich wartungsfrei.
Durch das gleiche Prinzip können auch Heizungsanlagen vor Korrosionen bewahrt werden. Hierbei wird ein Reaktionsbehälter in den Heizkreislauf eingebaut. In diesem Behälter wird der Sauerstoff durch die Anode gebunden und der pH Wert des Wassers wird angehoben.