Was ist Kalk
Was allgemein als Kalk bezeichnet wird ist eine Verbindung der Elemente Calcium (Ca) und Magnesium (Mg) mit weiteren Elementverbindungen wie z. B. Carbonat, Sulfat, Silikat, Phosphat, Fluorit und Chlorid. Calcium und Magnesium werden als Erdalkalimetalle bezeichnet.
Calcium:
Elementsymbol Ca (calx, lat.: Kalk) → Kalzium
Ca ist mit 3.39% das fünfthäufigste Element der Erde und das dritthäufigste Metall.
Magnesium:
Elementsymbol Mg (von der Stadt Magnesia in Kleinasien)
Mg ist mit einem Anteil von 1,94% in der Erdrinde und 0.13% im Meerwasser das achthäufigste Element
Natürlich vorkommende Kalkmineralien sind Kalkstein, Kreide, Marmor, Gips, Flussspat, usw. als Calciumverbindungen; sowie Magnesit, Kiserit, Carnallit, Olivin, usw. als Magnesiumverbindungen und Dolomit, in welchem beide Elemente gebunden sind. Tuffstein ist eine Ablagerung von ursprünglich gelöstem Kalk. Da der Kalk in freier Natur selten rein ist, weil in diesen Verbindungen diverse Elemente und Stoffe enthalten sind, besitzt er auch unterschiedliche Farben.

Wie kommt der „Stein“ ins Wasser
In reinem Wasser sind Calcium und Magnesium nur schwer löslich. In kohlensäurehaltigem Wasser hingegen beträchtlich.
Kohlensäure:
wässrige Lösung von Kohlendioxid (CO2) und Wasser (H2O)
Formel H2CO3. Kohlensäure, d.h. CO2 ist in jedem natürlichen Wasser in unterschiedlichen Mengen enthalten.
Durch Versickern und abfliessen des mit Kohlensäure gesättigten Regenwassers (CO2 aus der Luft gebunden) über die verschiedenen Gesteinsschichten, löst das Wasser die Calcium- und Magnesiumsalze aus dem Boden. Diese sind danach im Wasser als gelöste Carbonatverbindungen vorhanden; zum Beispiel als Calciumhydrogencarbonat Ca(HCO3)2
Calcium und Magnesium bilden zusammen mit Strontium und Barium die Wasserhärte.
Da in natürlichen Wässern praktisch keine Strontiom- und Barium-Ionen vorkommen, können diese vernachlässigt werden.
Die Wasserhärte wird in mmol/l (millimol pro Liter) in °fH oder in °dH angegeben (Grad französische oder deutsche Härte).
1 mmol/l = 10°fH = 5,6°dH = 100mg CACO3 (Kalk) pro Liter
Warum gibt es Kalkausfällungen?
Durch Erhitzen des mit Calciumcarbonat (Kalk) angereicherten Wasser verschiebt sich das Gleichgewicht der Löslichkeit infolge des Entweichens von CO2 aus dem Wasser. (Ausgasen der Kohlensäure). Der überschüssige Kalk bleibt zurück und setzt sich als sogenannter Kesselstein an den Heizflächen ab. Die Menge der Kalkausfällung ist abhängig von der Wasserhärte und der Temperatur des erwärmten Wassers. Die ablaufende Reaktion durch Erwärmung von kalkhaltigem Wasser kann anhand folgender Gleichung dargestellt werden:
Calciumhydrogencarbonat = Wasser + Kohlendioxid + Calciumcarbonat
Ca(HCO3)2 (Kalk; gelöst) = H2O + CO2 (entweicht) + CaCO3 (Kesselstein)
Energieverlust durch Ablagerungen
Durch Kalkausfällung entsteht der so genannte Kesselstein. Dieser lagert sich überall an den Heizflächen ab. In Boiler, Plattentauscher, Umformer, etc. welche kontinuierlich neues, mit mehr oder weniger Kalk angereichertes Frischwasser aufheizen, findet eine stetige Kalkablagerung statt. Auch zusätzlich eingeschwemmte Feststoffe wie Sand, Lehm, Rost und Organica (allg. Schlamm) lagern sich zusammen mit dem Kalk an den Flächen der Wärmeträger ab.
Diese Ablagerungen vermindern den Wärmedurchgang zunehmend. Hohe Ablagerungsstärken können soweit führen, dass die ursprünglich berechnete Heizleistung derart stark abnimmt, dass das ganze Warmwasser-System zum Erliegen kommt. Dies sollte jedoch auf keinen Fall in Kauf genommen werden, denn bis es zum „Infarkt“ kommt, wurde ein Mehrfaches der Energie aufgewendet, die bei blanken Wärmeträgern nötig wäre.
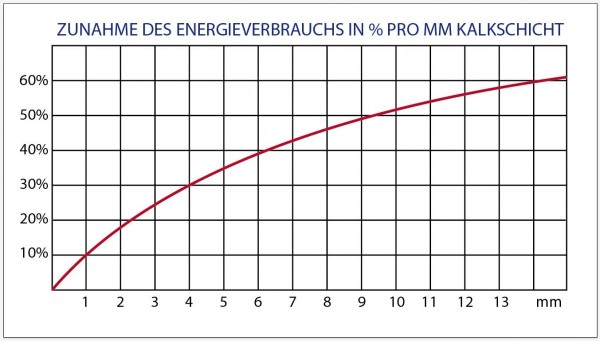
Aufbau der Ablagerungen
Der Aufbau und die Schichtstärken der Ablagerungen sind vor allem abhängig von der Wasserhärte (Menge der gelösten Calcium und Magnesium-Ionen), der Temperatur des erwärmten Wassers, der Temperatur der Oberfläche des Wärmetauschers, sowie des Volumens des erwärmten Wassers.
Es ist heute unbestritten, dass auch elektrostatische Magnetfelder die Ablagerungen beeinflussen können. Diese Magnetfelder sind jedoch nicht steuerbar, so dass eine zuverlässige Aussage nicht gewährleistet ist.
